 |


Ara que hem vist intuitivament en què consisteix la percolació, cal fer una petita disgressió cap a altres temes, per poder ser capaços d'entendre-la des d'un punt de vista formal.
Parlem en primer lloc de les transicions de fase. Tothom identifica fenomens quotidians, com l'ebullició de l'aigua o la fusió del gel, com a transicions de fase. El més característic de les transicions de fase és que tenen lloc quan a una substància es produeix un canvi de les propietats relacionades amb l'ordre a nivell microscopic. Per exemple, és molt diferent l'ordenació de les mol.lecules d'aigua quan formen un cristall de gel que quan formen aigua en estat líquid. Un altre tret destacable és que tan sols té sentit parlar de transicions de fase en sistemes formats per moltíssimes mol.lecules.
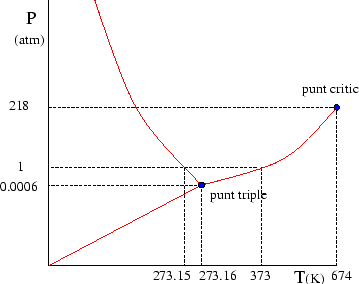
Per fixar idees, centrem-nos en el cas de l'aigua. Per a una pressió i una temperatura donades tan sols hi ha una fase en la que es pugui trobar. Podem fer un diagrama de fases que reculli informació experimental i ens indiqui quina és aquesta fase, en funció de la temperatura i de la pressió (veure Fig. 4).
Les línies que separen les fases s'anomenen línies de coexistència. Ens indiquen per a quins valors de temperatura i pressió podem tenir en equilibri dues fases simultaniament.
El punt crític, per la seva banda, és el final de la línia de coexistència líquid-vapor. Per a temperatures o pressions superiors a la del punt crític no hi ha una diferència clara entre la fase líquida i la fase gasosa.
Si volem dur el sistema des d'un punt situat en una fase fins a un altre
punt situat en una fase diferent, probablement haurem de creuar una línia
de coexistència. En aquest moment tindrà lloc una transició de fase
de primer ordre. Aquest tipus de transició es caracteritza per que mentre
succeeix, la capacitat calorífica és fa infinita.
Fixem-nos, sense anar més lluny, en l'ebullició de l'aigua. Comença a
bullir quan arriba als 100 ![]() i fins que no s'ha convertit completament
en vapor no és possible augmentar la seva temperatura. Tota l'energia
suministrada s'inverteix en alterar l'ordre de les mol.lecules.
i fins que no s'ha convertit completament
en vapor no és possible augmentar la seva temperatura. Tota l'energia
suministrada s'inverteix en alterar l'ordre de les mol.lecules.
Mentre dura la transició de primer ordre, l'aigua es troba a la línia de coexistència i per tant hi haurà una barreja de dues fases.
Si observem el diagrama de fases, és possible passar de la fase líquida a la gasosa sense passar per la línia de coexistència, fent un tomb que passi ``per sobre'' del punt crític. Encara que sembli mentida, això és possible i el resultat és que haurem convertit l'aigua líquida en vapor d'una manera gradual, sense cap canvi brusc i, per tant, sense cap transició de fase.
Finalment, és possible anar de la fase líquida a la fase gasosa ``trepitjant'' el punt crític. A sobre del punt crític tindrà lloc el que s'anomena una transició de fase de segon ordre. Des del punt de vista termodinàmic, la capacitat calorífica no es fa infinita durant aquest tipus de transició. Tan sols canvia de valor abruptament, però sense divergir en cap moment.
Abans de passar al proper apartat, pots fer l'activitat 1.
| Curiositat: El gel és tan sols una de 8 fases sólides en què pot existir l'aigua, encara que les altres tan sols es poden presentar en condicions artificials de pressió i temperatura. |

